文章信息:DOI:10.19668/j.cnki.issn1674-0491.2024.06.018 中图分类号:R733.1
引用信息:阮智慧, 耿清, 檀家俊, 等. 1例以肛周肿块疼痛为首发表现的弥漫大B细胞性淋巴瘤病例报告并文献回顾[J]. 结直肠肛门外科, 2024, 30(6): 742-748.

1例以肛周肿块疼痛为首发表现的弥漫大B细胞性淋巴瘤病例报告并文献回顾
1 南京中医药大学研究生院 江苏南京 210023
2 南京中医药大学附属南京中医院肛肠科 江苏南京 210022
3 江苏省中医肛肠疾病临床医学创新中心 江苏南京 210022
基金项目:南京市医学科技发展项目(YKK17151); 南京市卫生青年人才项目(QRX17902);
详细信息
通信作者:E-mail: 朱勇, zhuyong839@sina.com
Diffuse large B-cell lymphoma with perianal mass pain as the initial presentation: a case report and literature review
1 Graduate School, Nanjing University of Chinese Medicine, Nanjing 210023, Jiangsu, China
2 Department of Anorectal Surgery, Nanjing Hospital of Chinese Medicine Affiliated to Nanjing University of Chinese Medicine, Nanjing 210022, Jiangsu, China
3 Jiangsu Clinical Innovation Center for Anorectal Diseases of Traditional Chinese Medicine, Nanjing 210022, Jiangsu, China
淋巴瘤是一种免疫系统恶性肿瘤,其中弥漫大B细胞性淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)最常见的类型之一,约占30%~40%[1]。淋巴瘤按发病部位可分为结外淋巴瘤和结内淋巴瘤。发生于软组织的结外淋巴瘤较为罕见,仅占所有淋巴瘤的0.3%[2],因无典型临床表现,术前确诊困难,临床误诊率高。现将南京中医药大学附属南京中医院肛肠科收治的1例以肛周肿块疼痛为首发表现,经术后病理确诊为DLBCL的诊治过程,与同道交流,希望通过分享本例患者非典型的MRI表现并回顾复习近年来有关软组织淋巴瘤的文献,提高临床医师对此病的认识,避免误诊及漏诊。
1 临床资料
1.1 病史简介
患者女性,73岁,因“肛周肿块疼痛间歇性发作1月余”入院。患者自诉1月余前右侧卧位时发现一肛周肿块,初为轻压痛,无破溃溢液,大便日行1~2次,质软成形,无黏液血便,无肛门坠胀感,未予重视。后肛周肿块疼痛较前加重,遂于2024年4月22日来我院门诊就诊,门诊以“肛周肿块”收治入院。发病以来患者否认恶寒发热、盗汗乏力、体质量减轻等症状。既往有“高血压病、糖尿病”病史,有“结肠部分切除术、脊柱及两侧骶髂关节内固定术、右膝关节置换术”手术史。已绝经23年,适龄结婚,育有3女,无流产、早产史。
1.2 专科检查
体温正常,浅表淋巴结未触及肿大,腹平软,无压痛。肛门外观尚平整,右侧近肛缘皮下可触及一肿块,大小约5 cm×7 cm×3 cm,质韧,活动度差,表面皮肤色暗红、无破溃,皮温稍高,直肠指诊同侧可触及腔外肿块,压痛(+),退指指套无血染。
1.3 辅助检查
(1)实验室检查。完善三大常规、C反应蛋白、肝肾功能、电解质、血脂四项、传染病四项等检查,其中C反应蛋白(24.9 mg/L)升高,D-二聚体(3.14 mg/L FEU)升高,乳酸脱氢酶(lactate dehydrogenase,LDH)(353 U/L)升高,白蛋白/球蛋白比值(1.03)、白蛋白(33.6 g/L)、前白蛋白(148.1 mg/L)、估算肾小球滤过率(69 mL/min)降低,余未见明显异常。
(2)器械检查。①体表彩超提示:臀部皮下不均匀回声,大小约5.0 cm×3.1 cm,形态欠规则,边界欠清楚。②肛门直肠腔内超声检查(图1):截石位7~11点位外括约肌外侧见不均匀回声区,内见极少血流信号,未见明显与肛门相通。③盆腔CT平扫+增强检查:未见异常增大的淋巴结影。④盆腔MRI检查(图2):右侧臀部皮下间隙内可见一团块状不规则软组织信号肿块,T1WI稍低信号,T2WI稍高信号,边缘呈环形,弥散加权成像(diffusion weighted imaging,DWI)呈高信号,表观扩散系数(apparent diffusion coefficient,ADC)值降低,中间呈结节状,DWI呈稍低信号,ADC高信号;右侧肛提肌信号增高,周围脂肪间隙信号增高,考虑侵犯部分外括约肌;双侧腹股沟区可见较大的淋巴结,其短径约1.2 cm。⑤电子结肠镜检查(图3):进镜抵达回横吻合口,吻合口光整。距肛缘40 cm降结肠处见一枚大小约0.8 cm×0.8 cm的息肉,余肠段未见异常。同患者沟通后,行内镜下结肠黏膜切除术,病理结果显示:(降结肠)管状腺瘤,伴低级别上皮内瘤变。
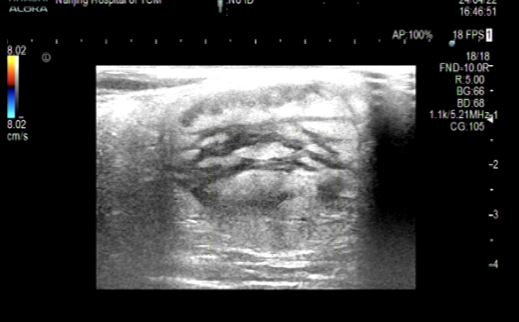
图1 肛门直肠腔内超声图像
Fig.1 Anorectal endoscopic ultrasound image
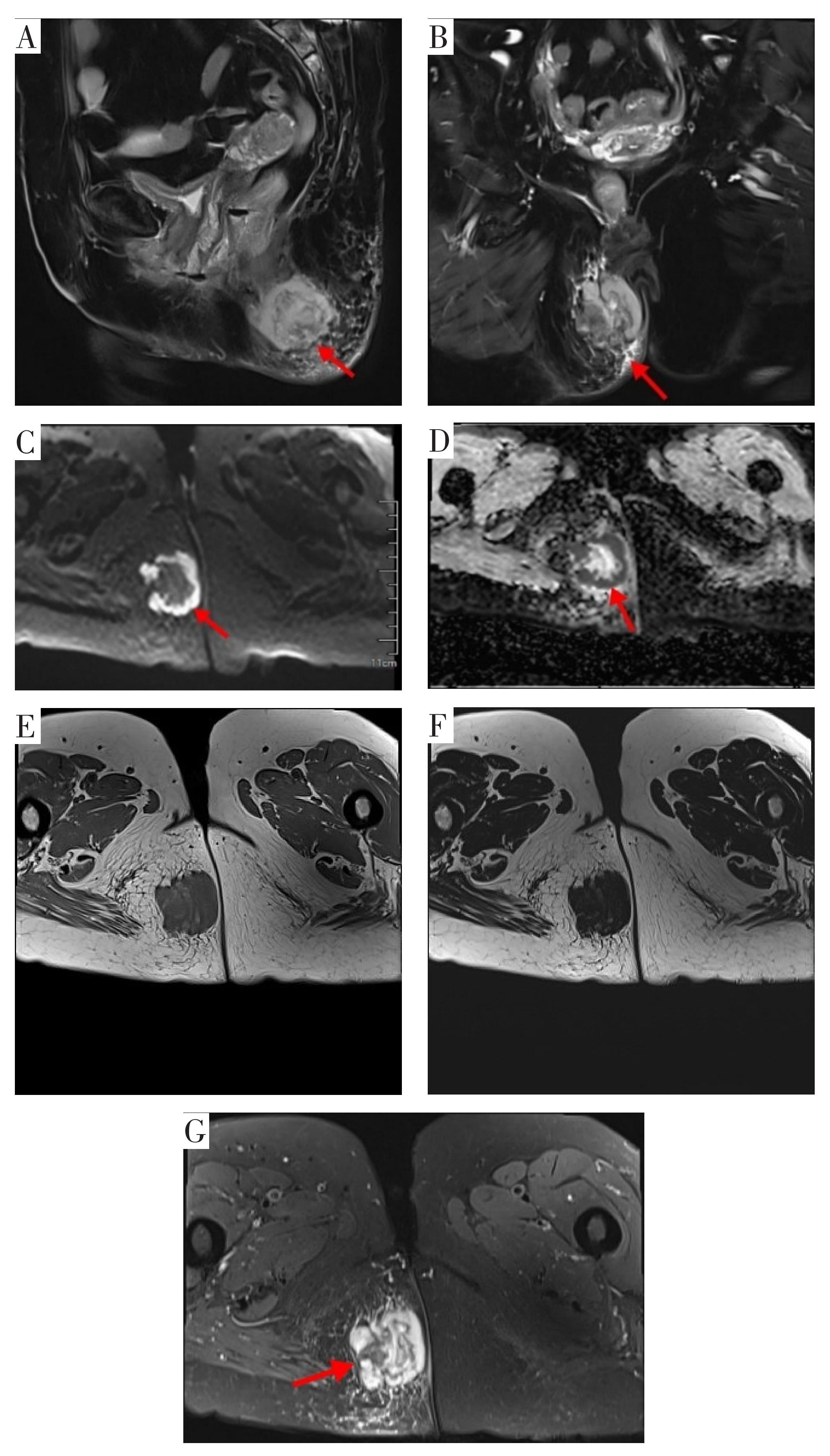
A.肿块位于右侧臀部皮下间隙内(矢状位);B.肿块位于肛管附近(冠状位);C.病灶边缘呈环形DWI高信号影;
D.病灶边缘呈ADC低信号影;E.病灶T1WI呈等、低信号影,中间可见条状较高信号分隔;F.脂相示病灶大体信号减低,提示病灶有囊变;
G.水相示病灶内高信号且不均匀,病灶内见分隔样改变,提示富含黏液成分。
图2 盆腔MRI检查图像
Fig.2 Pelvic MRI images
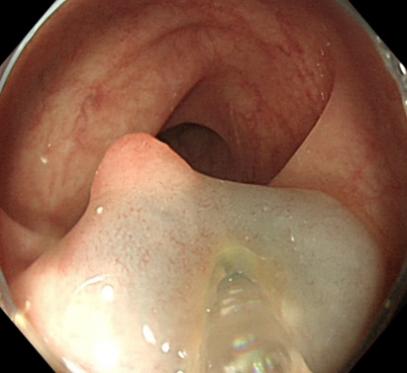
图3 电子结肠镜检查图片
Fig.3 Electronic colonoscopy image
1.4 治疗相关情况
完善相关检查后未能明确肿物性质,经科室讨论拟于2024年4月26日行肛周肿物切除术(图4)。术前排除手术及麻醉禁忌证。硬膜外间隙阻滞麻醉满意后,取俯卧位,于距离右侧肛缘4 cm的肿物上方作一弧形切口(图4A),电刀逐层切开皮肤、皮下组织,切口长约7 cm,用Allis钳钳夹皮缘,充分暴露肿物,见一囊性肿物。以电刀沿肿物边缘仔细剥离,避免肿物破损,见肿物左侧与部分外括约肌紧密粘连(图4B),遂连同部分外括约肌完整切除肿物(图4C),患者过目后送病理,术毕。标本剖开肉眼观:切面为灰黄色,质地细嫩,似鱼肉状(图4D)。
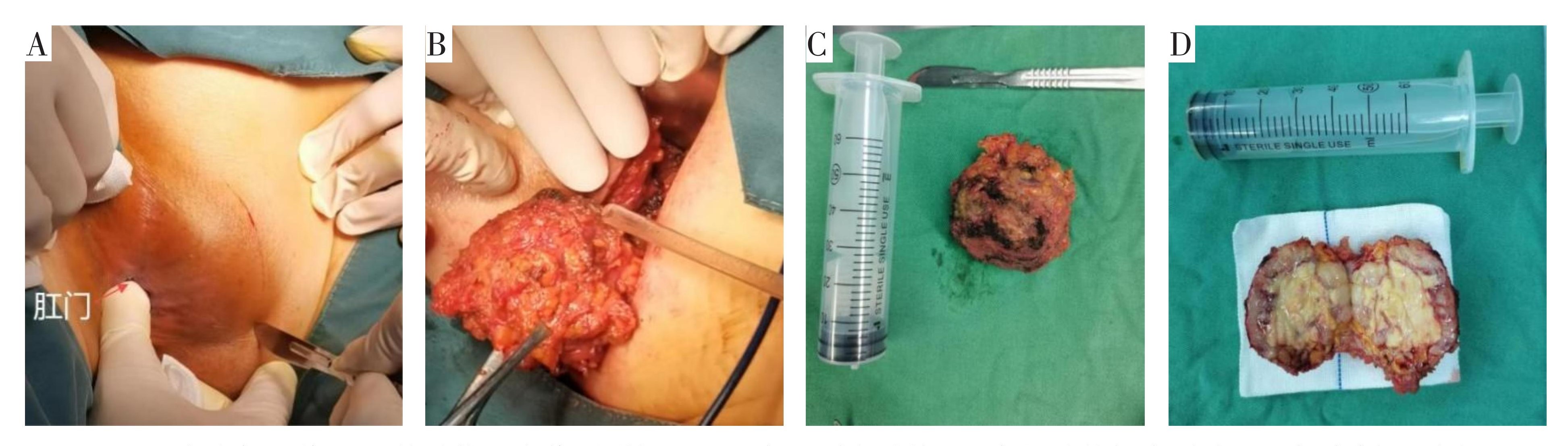
A.于距离右侧肛缘4 cm的肿物上方作弧形切口;B.完整剥离肿块;C完整肿物标本图片;D.标本剖开图片。
图4 手术图片
Fig.4 Operation images
术后病理结果显示:(臀部)圆细胞性恶性肿瘤,结合苏木精-伊红染色(图5)及免疫组化结果诊断本例为弥漫大B细胞性淋巴瘤,生发中心后亚型。免疫组化结果(部分见图6):CK(-),CD34(-),CD20(3+),CD3(-),CD117(-),Desmin(-),Dog-1(-),CD99(+),Ki-67(约90%+),S-100(-),CD30(-),C-myc(约40%+),Bcl2(-),Bcl6(约30%1+),CD10(-),MUM1(2+),PAX5(2+),ALK(-)。
镜下见肿瘤形态较一致,呈中等大圆形细胞,弥漫片状分布,×400。
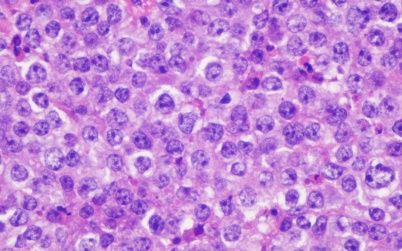
图5 苏木精-伊红染色结果
Fig.5 Hematoxylin-eosin staining result image 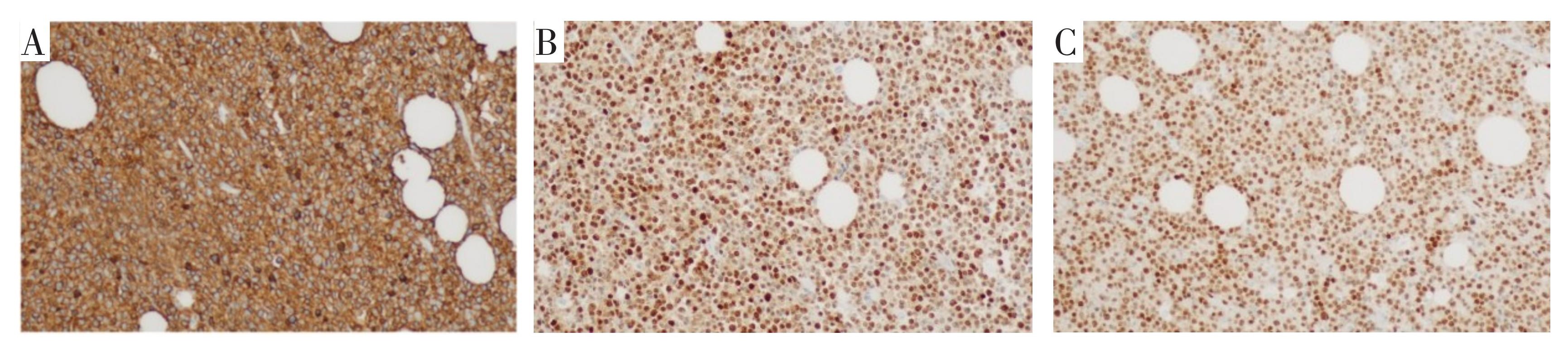
A.CD20(3+);B.MUM1(2+);C.PAX5(2+);×100。
图6 免疫组化结果
Fig.6 Immunohistochemical results images
术后予对症抗感染治疗,辅以中药熏洗、坐浴,创面每日换药2次。
1.5 术后随访与治疗
术后每月随访1次,患者出院2周后于外院继续行术后放化疗辅助治疗,2024年5月20日在外院行辅助治疗前的PET/CT检查:纵隔血池SUVmax=2.7,肝脏SUVmax![]() 3.8,考虑淋巴瘤多发累及。2024年5月23日患者在外院完善骨髓穿刺术:未识别出成熟B细胞淋巴瘤细胞。2024年5月24日于外院行R-CDOP方案化疗(具体不详),后分别于2024年6月18日、2024年7月10日在外院行第2、第3周期R-CHOP方案【利妥昔单抗(得利妥)600 mg d0,环磷酰胺1 g d1,表柔比星100 mg d1,长春新碱2 mg d1,泼尼松40 mg bid d1-5】治疗,因患者第1、第2周期化疗后出现发热、泌尿道感染,第3周期化疗予减低糖皮质激素剂量。2024年8月6日患者再次于外院行PET/CT检查(中期评估):纵隔血池SUVmax=2.2,肝脏SUVmax=3.2,与2024年5月20日PET/CT检查结果比较:FDG代谢未见增高,PET上肿瘤活性基本受抑制,疗效评估为完全缓解。患者2024年8月13日于外院行第4周期化疗,具体化疗方案同第3周期。
3.8,考虑淋巴瘤多发累及。2024年5月23日患者在外院完善骨髓穿刺术:未识别出成熟B细胞淋巴瘤细胞。2024年5月24日于外院行R-CDOP方案化疗(具体不详),后分别于2024年6月18日、2024年7月10日在外院行第2、第3周期R-CHOP方案【利妥昔单抗(得利妥)600 mg d0,环磷酰胺1 g d1,表柔比星100 mg d1,长春新碱2 mg d1,泼尼松40 mg bid d1-5】治疗,因患者第1、第2周期化疗后出现发热、泌尿道感染,第3周期化疗予减低糖皮质激素剂量。2024年8月6日患者再次于外院行PET/CT检查(中期评估):纵隔血池SUVmax=2.2,肝脏SUVmax=3.2,与2024年5月20日PET/CT检查结果比较:FDG代谢未见增高,PET上肿瘤活性基本受抑制,疗效评估为完全缓解。患者2024年8月13日于外院行第4周期化疗,具体化疗方案同第3周期。
截至2024年8月20日,患者自诉肛门控便能力正常,未出现大便失禁,无肿瘤复发及转移,术后创面尚未愈合(图7),每日清洁换药,继续随访观察。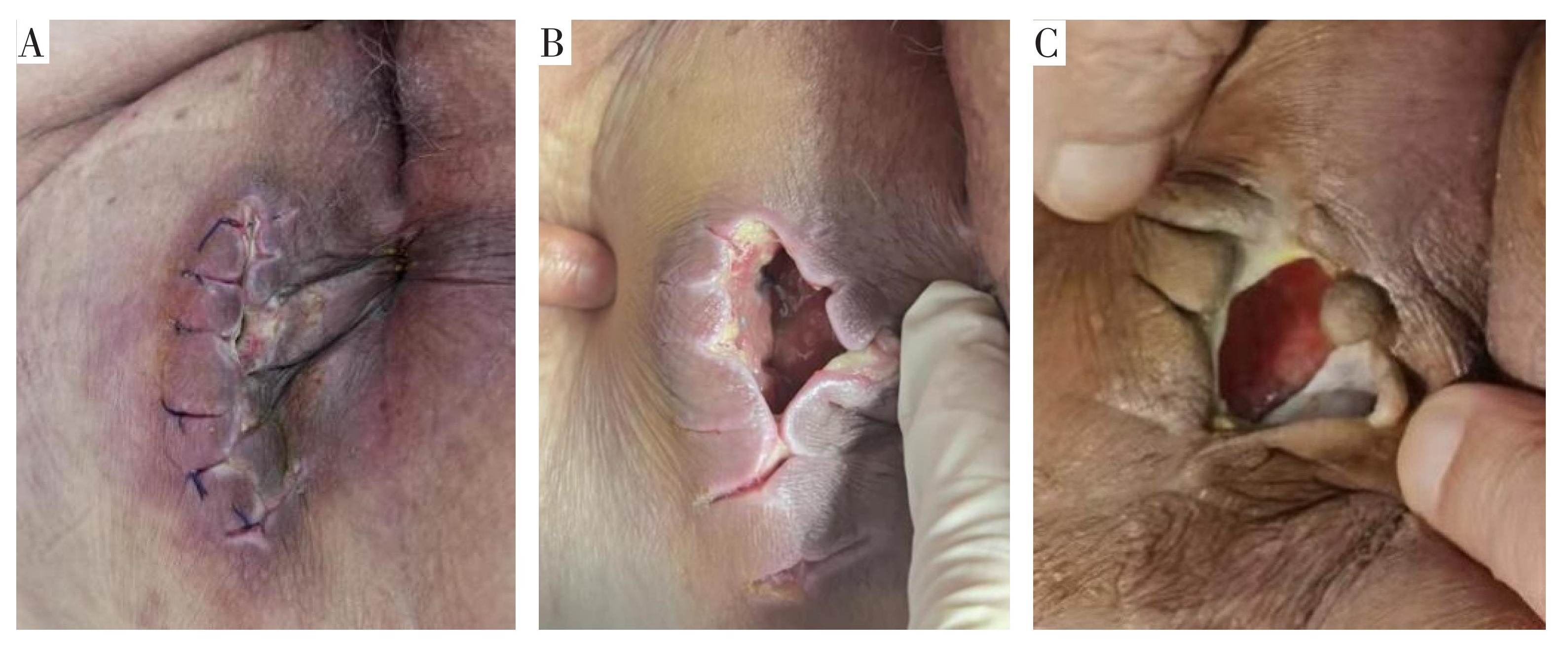
A.创面皮肤颜色呈紫红色,内有较多脓性分泌物(术后1周);B.创面有少量分泌物,创面未愈合(术后1个月);
C.创面无明显分泌物,创面未愈合(术后3个月)。
图7 术后创面愈合情况
Fig.7 Postoperative wound healing status images
2 讨论
淋巴瘤是一种免疫系统恶性肿瘤,以NHL多见,其中DLBCL是NHL最常见的组织学类型。目前淋巴瘤的病因尚不明确,研究表明多与病毒感染(如HIV)、遗传因素、职业和环境暴露、器官移植和自身免疫性疾病(如类风湿性关节炎)等[3-6]潜在病因有关。发于结外淋巴组织或不含淋巴组织的器官的恶性淋巴瘤为结外淋巴瘤,以胃肠道受累最多见,而发生在软组织中的结外淋巴瘤较为罕见。软组织淋巴瘤分为原发性和继发性,原发性软组织淋巴瘤仅以软组织肿块起病而无其他部位的淋巴结或结外病变[7],继发性软组织淋巴瘤通常是由淋巴结或其他结外病变直接扩散或血行转移至软组织所致[8]。软组织淋巴瘤临床多见于60岁以上的老年患者,主要表现为局部疼痛或无痛的肌肉软组织肿胀,体积迅速增大,多数为单发。本文报道的病例为老年女性患者,结合其转移情况,最终诊断为以肛周肿块疼痛为首发表现的全身性DLBCL,比较少见。
临床上确诊软组织淋巴瘤比较困难。影像学检查是软组织淋巴瘤的常用诊断方法,但缺乏特异性,多用于初步筛查。软组织淋巴瘤在X线检查中仅能显示软组织肿胀,诊断价值相对有限。超声检查显示肿块边界不清、形态不规则、内部回声低且回声不均、血流信号丰富[9],此外,淋巴瘤累及肌肉时,受累肌肉基本形态轮廓完整,长轴沿肌纤维方向延伸,部分皮下软组织淋巴瘤还可见肿块内条索状和网状改变[10]。CT检查下表现为肌肉内低密度或等密度肿块[2],增强后呈轻—中度均匀强化,可观察到受累肌肉弥漫性增大,伴或不伴脂肪平面的丢失[11]。然而,软组织淋巴瘤在超声和CT检查中缺乏特异性表现,难以与其他类型的软组织肿块明确区分,临床上应结合其他检查来综合评估和诊断。MRI检查对典型的软组织淋巴瘤的诊断具有一定的特异性。Surov等[12]发现软组织淋巴瘤在DWI上多表现为弥散受限。与肌肉淋巴瘤相比,软组织淋巴瘤T1WI多呈稍低信号或等信号,T2WI呈稍高信号,DWI呈高信号,ADC呈低信号,且普遍低于其他软组织恶性肿瘤。本例患者的MRI检查结果提示右侧臀部皮下间隙内见一团块状不规则软组织信号肿块,T1WI稍低信号,T2WI稍高信号,边缘呈环形,DWI呈高信号,ADC呈低信号,与Surov等[12]的文献报道相符。肌间筋膜脂肪间隙的存在是软组织淋巴瘤与其他软组织疾病的主要鉴别点。周良平等[13]研究表明,在其他病变范围较广、肌肉受累较多的软组织疾病中,肌间筋膜脂肪间隙常有部分受累或被压迫,导致其在MRI检查上显示不清,软组织淋巴瘤行MRI增强扫描后肿块可呈轻、中度均匀强化,程度多介于肌肉和血管之间。本例患者因腰椎术后放置钢钉,未进一步行MRI增强检查,无法确定其是否存在强化后的特征。此外,软组织淋巴瘤病灶一般无液化、坏死或囊性改变,信号均匀[14]。本例患者T2WI高信号且不均匀,病灶内可见间隔及黏液样改变,我们认为这种特殊的表现可能与肿块位于肛周,为腔外生长,且周围多是疏松组织有关,提示临床医师在诊断时不应局限于常规淋巴瘤的“密集”影像学表现。PET/CT检查是一种利用放射性核素标记的葡萄糖类似物(如18F-FDG)作为示踪剂,将功能显像(PET)与解剖显像(CT)相互结合的非创伤性检查手段。淋巴瘤细胞具有较高的代谢活性,其对葡萄糖的摄取量远高于正常细胞。PET/CT检查通过检测高代谢区域来识别淋巴瘤的存在和分布,目前多用于淋巴瘤初级分期、治疗后反应评估及预后预测。研究显示,PET/CT检查对结外淋巴瘤的敏感性和特异性分别为88%~97%和100%[15-16]。因此,对于高度怀疑淋巴瘤但拒绝进行侵入性检查的患者,PET/CT检查是较为合适的诊断选择。
组织病理学检查是诊断软组织淋巴瘤及其分型的“金标准”,手术切除活检(surgical excision biopsy,SEB)、细针穿刺细胞学活检(fine needle aspiration,FNA)和超声引导下经皮粗针穿刺活检(core needle biospy,CNB)是主要的取样方法。欧洲肿瘤医学协会(European Society for Medical Oncology,ESMO)指南提出SEB是诊断淋巴瘤分型的理想方法[17]。本例患者采用SEB方式,经免疫组化分析后确诊为弥漫大B细胞性淋巴瘤。然而,SEB具有高度侵入性,不仅会增加医疗费用和术后并发症,还会因手术等待及术后恢复时间较长而延误治疗。FNA廉价、速度快、创伤小,具有较高的敏感性和特异性,但由于抽吸量有限难以进行免疫组化,因此多数情况下无法对淋巴瘤进行亚型分析。CNB在局麻下经超声或CT引导进行,具有廉价、时间短、侵入性小、患者耐受性好的优点,且病灶保持原位,可以在初始治疗后进行更准确的治疗监测。文献报道CNB对疑似淋巴瘤的诊断准确率与SEB相当,可作为SEB的替代方法[18-20]。
对于软组织淋巴瘤而言,手术切除并非是首选治疗方法,但当肿物巨大或位置特殊而出现压迫症状、穿孔和出血等情况时,可以考虑手术切除。软组织淋巴瘤的治疗多采用放化疗、靶向治疗和免疫治疗,其中R-CHOP方案(利妥昔单抗、环磷酰胺、多柔比星、长春新碱及泼尼松)是DLBCL的标准化疗方案[21]。对于老年或伴有心血管疾病或相关危险因素的DLBCL患者,推荐采用R-CDOP改良化疗方案(利妥昔单抗、环磷酰胺、脂质体多柔比星、长春新碱及泼尼松)[22],有利于减轻化疗对免疫功能的影响,但有30%~40%的患者在化疗后复发或在初次化疗后发展为难治性疾病[23],这些患者可选择补救性化疗如高剂量治疗联合自体造血干细胞移植[24]或嵌合抗原受体T细胞[25]治疗。本例患者术后于外院拟行6个周期R-CHOP化疗联合2次放疗方案治疗,目前已完成4个周期化疗,中期疗效评估提示完全缓解,后续按原方案治疗。
预后评估是DLBCL治疗过程中不可或缺的环节,它可以指导个体化治疗、预测疾病进展、评估治疗效果以及优化治疗方案,有助于提高患者生活质量。国际预后指数(international prognostic index,IPI)是目前最常用的淋巴瘤预后评估方法,根据淋巴瘤分型的不同,IPI的各类指标也不尽相同。DLBCL的IPI包括年龄、体力状态评分、临床分期、结外器官侵犯数量、LDH水平这5项指标,每项指标按标准计为0或1分,总分5分,得分越高,危险度越高,预后越差[26]。本例患者IPI评分为5分,属于高危组,考虑预后欠佳。但IPI不能反映DLBCL生物学异质性(如,基因分型)和肿瘤微环境(机体免疫和炎症反应)等因素对预后评估的影响。基因检测虽然能提供精细的评估信息,但操作相对复杂且昂贵。骨髓穿刺是一种侵入性检查,患者依从性较差。PET/CT检查可用于预后评估,还可以作为一种早期预测患者化疗反应的工具,若患者在完成几个周期的化疗(通常为6~8个周期)后PET/CT结果呈阴性,这表明化疗药物对肿瘤细胞的杀伤力足够高,可以在治疗结束时达到缓解[27],但其检查费用较高且存在一定的辐射风险。Wu等[28]回顾性分析了212例原发性DLBCL成年患者的LDH、血清白蛋白(ALB)和乳酸脱氢酶/白蛋白比值(LAR)的表达水平,发现高LDH(LDH ≥ 301 U/L)和低ALB(ALB ≤ 38 U/L)水平是预后不良指标,且高LAR(LAR ≥ 6)水平是总生存期和无进展生存期预后不良的独立危险因素。因此,临床医师可以结合多种预后评估方法,为患者提供更准确的预后评估及个性化的治疗方案。
本例患者已随访4个月,术后创面仍未愈合,这可能反映了大多数肛肠科医师在诊断和治疗肛周肿块的思维局限性,认为肿块位于肛周,不累及重要器官,手术切除既不影响肛门功能又能明确诊断,忽略了血液系统疾病的可能性。此外,创面位于肛缘附近,容易被粪便污染,引起感染,使愈合缓慢,甚至延误后续治疗。
综上所述,对于临床表现为肛周软组织肿块伴疼痛的患者,其MRI检查提示弥散受限,T1WI稍低信号,T2WI稍高信号,在淋巴组织丰富的部位(如腋窝、腹股沟、腹膜后)有肿大淋巴结,病灶内有实性、囊性表现,应考虑软组织淋巴瘤,并进一步完善PET/CT、病理检查以明确诊断。若确诊软组织淋巴瘤,应组织多学科讨论,综合IPI、PET/CT检查、血液检查、基因检测及骨髓抽吸活检等方法评估预后,实施个体化治疗,为患者带来更好的生活质量和更长的生存时间。
利益冲突声明 全体作者均声明不存在与本文相关的利益冲突。